根据最新的研究论文,科学家们已成功开发出一种方法,可以在蛋白质复合物中构建人工变构位点,这一过程通过结合效应分子来调节远端活性位点的活性。这项具有突破性的研究在工业、生物医学和农业等多个领域展现出广泛的应用潜力,相关成果已发表在《自然化学》期刊上。
蛋白质复合物,如血红蛋白和分子马达,依靠亚基之间的协作来实现其功能,这一过程是通过变构机制来实现的。
变构效应是指通过效应分子与另一个亚基的变构位点结合,来调节亚基活性位点的功能。这一概念最早在20世纪60年代提出,至今仍是生物化学研究的重要课题之一。
一个研究团队已提出一种策略,旨在将人工变构位点设计到蛋白质复合物中,以调节其协同功能。大阪大学的古贺信康教授表示:“在蛋白质复合物中创造人工变构位点,可能会揭示变构的基本原理,并为合成生物学提供新的工具。”
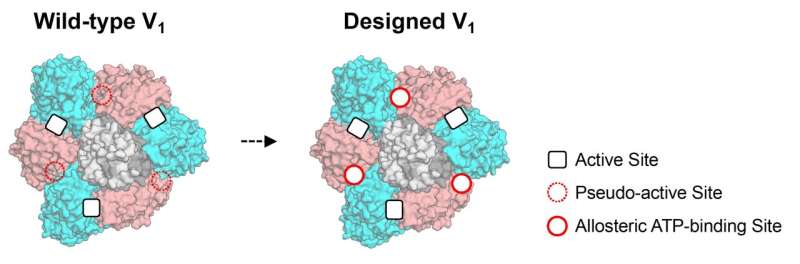
研究团队假设,蛋白质复合物中的变构位点可以通过恢复在进化过程中可能丢失的伪活性位点的功能来实现。多种蛋白质复合物中均包含具有伪活性位点的亚基。
研究表明,伪活性位点与其他亚基的活性位点之间存在变构联系。例如,一个亚基中的伪活性位点虽然失去了ATP酶活性,但仍能结合ATP,并在结合时激活另一个亚基的活性位点。在细胞层面,ATP是能量的来源,而ATP酶则描述了酶分解ATP的能力。这些研究支持了通过工程伪活性位点来创建不同变构位点的观点。
研究团队利用计算设计恢复了旋转分子马达(V1-ATPase) b亚基伪活性位点失去的ATP结合能力。首先,通过X射线晶体学实验揭示了设计位点的结合能力。“X射线结构显示,结合位点成功设计并整合到天然蛋白质中,具备功能。我对高性能蛋白质设计技术的实用性感到惊讶,”材料结构科学研究所的副教授Mikio Tanabe表示。
接下来,他们通过X射线晶体学分析的单分子实验发现,与野生型相比,ATP与设计的变构位点的结合增强了V1的活性,并且可以通过调节ATP的结合亲和力来调控旋转速率。该团队在旋转马达中实现了协作性。
此外,与野生型相比,团队设计的变构位点能够加速旋转,而非减速。“据我们所知,通过蛋白质工程加速旋转分子马达是首次取得的成就。这是该领域一个令人振奋的结果,”日本国立大学的柳野良太教授表示。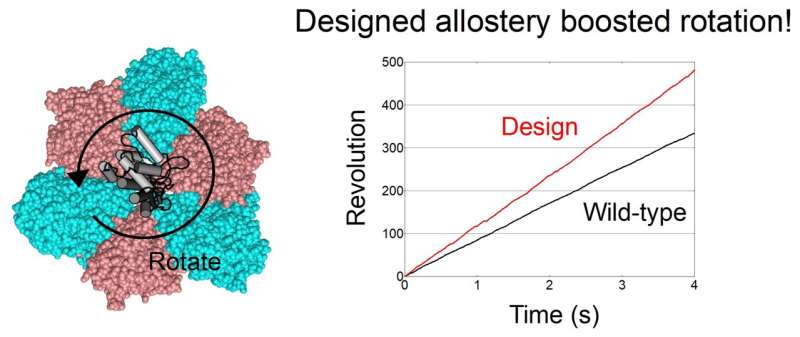
伪活性位点在自然界中普遍存在,其方法有望成为编程变构以控制蛋白质复合物协同功能的手段。此外,蛋白质设计方法不仅可以恢复失去的功能,还可以设计其他配体的结合位点。
“原则上,我们的策略使我们能够在各种蛋白质复合物中创建变构位点。我们的下一步是通过我们的策略创建多种蛋白质复合物的变构控制。此外,我们还将尝试在伪活性位点中设计新的功能。我们的目标之一是人工控制任何蛋白质复合物的协同功能,并揭示变构的一般机制。我们希望对蛋白质复合物协同功能的变构控制将为酶的工业应用或生物医学和农业领域开辟新的途径,”国立自然科学研究所的助理教授Takahiro Kosugi表示。
本文来自作者[滕希慕]投稿,不代表机制号立场,如若转载,请注明出处:https://m.jzwrb.cn/zlan/202508-4518.html


评论列表(4条)
我是机制号的签约作者“滕希慕”!
希望本篇文章《科学家们提出了一种新策略,用于在蛋白质复合物中构建人工变构位点》能对你有所帮助!
本站[机制号]内容主要涵盖:国足,欧洲杯,世界杯,篮球,欧冠,亚冠,英超,足球,综合体育
本文概览:根据最新的研究论文,科学家们已成功开发出一种方法,可以在蛋白质复合物中构建人工变构位点,这一过程通过结合效应分子来调节远端活性位点的活性。这...